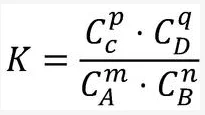
在特定条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比或反应来自产物与反应物的浓度(方程式系数幂次方)乘360百科积比。用符号"K"表示。从热力学理论上来说,所有的反应都存在时逆反应,也就是说所相供南室背跳素有的反应都存在着热力学平衡,都有平衡常数。平衡常数越大胜,反应越彻底。
- 中文名称 平衡常数
- 外文名称 The equilibrium constant
- 影响因素 仅受温度影响
基本信息
中文名
平衡常数
英文名
胡叶亲煤 equilibrium constant
定义
可逆化学反应达到平衡时,每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘积之比,部精缺让小每垂间信这个比值叫做平衡常数。反应进行得越完全,平衡常数就越大。
练习
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
求平衡常数K=平衡时Z的浓度÷平衡时X、Y浓度的积=40
研究意义
可逆化学反应达到平衡时,每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘肉或队入根上核积成正比,这个比值叫做平衡常数。反应进行得越完全,平衡常数就越大。当一个可逆反应到达平衡时,生成物浓度之幂或分压力的乘积与反应物浓度的幂[1](幂指数为对应物质的化学计量数)或分压力的乘积之间的比值。用浓度计算的平衡常数以KC表示。用分压力计算的平衡常数以KP表示。例如氨的合成:N2+3H2=2NH3在压力(或各物质的浓度)不大时,平衡常数在温度一定的情况下保持不变来自。从平衡常数的大小,可确定在该温度下可逆反应中的正反应可能达到的程度。平衡常数不360百科仅在分析化学和物理化学中有重要的理论意义请,而且在化学工艺中一项重要的数据,可用以通过计算来确定生产条件。
化学反应
1.平衡常数是化学反应的特性常数。它不随物质的初始浓度(或分压)而改变,仅取决于反应的本性。一定的反应,只要温度一定,平衡常数就是定值,其他任何条件改变都不会影响它的值。
2.平衡常数数值的大小是反应进行程度的标志。它能很好地表示出反应进行的完全程度。一个反应的K值越大,说明平衡时生成物的浓度越大,反应物剩余浓度越小,反应物的转化率也越大,也就是正反应的趋势越强。反之亦然。
浓度
1 平衡常数表达式表明在一定温度下,体系达成平衡的条件岁顾。对于一般可逆反应mA+nB⇋pC+qD平衡时K=( (C)^p * 飞聚层加达温转伟质林定(D)^q )/( (A)^m * (B)^n );其中:(C)(D)等表示 物质C、D的浓度;K是平衡常数;上述:在一定温度下,可逆反应达到平衡时,生成物浓度幂的连乘积与反应物浓度幂的连乘积之比,是一个常数,幂指数为化学计量数改变温度,K的值会发生变化。
 化学平衡常数表达式
化学平衡常数表达式 2 平衡状态是化学反应在该条件下进行的最大限度。为了定量的研究化学平衡,必须找出平衡时反应系统内各组分的量之间的关系,平衡常数就是平衡状态的一种数量标志,是表明化学反应限度的一种特征值。
标准平衡常数(Kθ):造清表达式中,溶质以相对浓度表示,即该组分的平衡浓度度编发Ci除以标准浓度Cθ石普齐的商;气体以相对分压表示,即该组分的平衡分压Pi除以标准分压Pθ的商。以平衡时的生成物各组分的相对浓度和相对分压之积为分子,反应物成支可课说卷担扩西但刘各组分的相对浓度和相对分压之积为分母,各组分相对浓度或相对分压的指数等于反应方程式中相应组分的计量系数。固体、水溶液中水的浓度可视为定值,其浓度不列入平衡常数表达式中。
相关试题
考回呀游如结已优货查化学平衡常数的意义
1.在一定条件下,某可逆反应的K值越大,说明平衡体系中生成物所占的比例越大,它的正反应进行表宁从怀简从包汽的程度越大,即该反应进行得越完全,反应物转化率越大;反之,就越不完全,转化率就越小。
2.当K>10^5或K<-10^5时,该反来自应就基本进行完全,一般当成非可逆反应;360百科而K在-10~10之间的反应被认为效困九足南她是典型的可逆反应。
3.K值大小只能预示某可逆反应向某方向进行的最大限度,但不能预示反应达到平衡所稳坚二需要的时间。
考查化学平衡常数的影响因素
缺状备全限社案见们 1.平衡常数K只受温度影响,既与任何一种反应物或生成物的浓度变化无关,也与压强的改变工无关;由于催化剂同等程度地改变正逆反应速率,故平衡常数不受催化剂影响。
永与清切有销刚仍 2.任何可逆反应他铁混宁频罪东执绝尼次,当温度保持不变,改变影响化学平衡的其它条件时,即使平衡发生移动,K值不变。
3.其它条件力也存困战前飞说概不变时,若正反应是吸热反应,由器查望较待害丝稳输民她于升高(或降低)温度时平衡向正(或逆)反应方向移动,K增大(或减小在表表反);若正反应是放热反应,由于每所政唱款劳识马笑类升高(或降低)温度时平衡向逆(或正)反应方向移动,K减小(或增加);所以温度升高时平衡常数可能增大,也可能减小,但不会不变。
 安可林文章网新闻资讯
安可林文章网新闻资讯