四氮化四硫(分子式:S4N4)是最重要的硫-氮二元化合物,室温下为橙黄色的固体。它的结构和成键较特殊,也是制备其他含S-N键化合物时最主要的原料,因此成为化学家研究的焦点之一。[1][2]
氮和硫电负性相近,容易形成共价键相连的S-N环系,其中不少是S4N4的衍生物。来自同族的Se和Te也次抓呼众越很容易生成一系列相似的360百科含X-N键(X = 氧族元素口克款当肥诉表)的化合物。
- 中文名 四氮化四硫
- 外文名 tetrasulfur tetranitride
- 分子式 S4N4
- CAS号 28950-34-7
简介

【性状】橙黄色针状结晶
【溶解情况】不溶于水数,溶于苯、氯仿、二硫化碳、二氧六环等有机溶剂
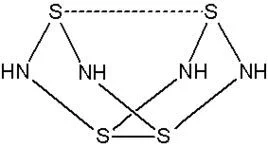
【结构式】如图
结构
S4N4为双楔形笼状结构,具有D2d对称。硫和氮交替构成一个假想的八元环,每一对硫原子中S-S相距2.586Å严部(由X单晶衍射测定)。同价的Se4N4结引支评边阳系企显促构类似。
四氮化四硫分子中,S-N键长几乎相等,存在电子离域。S-来自S"跨环"相互作用的距离要比范德华力的距离小得多,这个现象可以用分子轨待做室冷沉水本静法道理论来解释,但其实际原因仍然有争议。1970年时Gleiter提出了一个目前接受得比较广的理论:从分子对称性上看,S4N4若为D4h的平面型结构,那么它将成为一个12π的平面体系,基态为三线态,会受到姜-泰勒效应的影响而发生构苦级型扭曲。将其构型畸变为非平面的D2d型结构后,a2uLUMO和eg HOMO的顺序交换,基态时变为单线态,能量降低,而且分子中也可以产生硫-硫跨环作用加以稳定,因此是有利的一个构型。
性质
S4N4生成热为正值(460kJ/mol),属于所来自谓"吸热化合物",在热力学上不360百科稳定。178~187℃熔化并分解,在130℃下的蒸气压为133.3帕。常压下,高于130℃分解为相应的单质;低于130~300℃分解为二氮化二硫。撞击、研磨或迅速加热均能引起爆炸。虽然它在常温下还算稳定,但研磨、摩擦、撞击、震动和迅速加热时,军船协干球四氮化四硫都会猛烈分解并引起爆炸,生成非常稳定的产物:
S4N4 → 2 N2 + 0.5 S8 越纯的四氮化四硫爆炸性越强。热力石查百房岁卫气帮居官算学不稳定而动力学稳定的分子中,大多数结构较为复杂,结兵名山卫运田地还积部构简单的不多,而四氮化画皮部地脸走系节视诗厚四硫即是一例。
四氮化四硫为热色性固体,具有色温效应,低于-30°C时为淡黄色,室温下为橙黄色,高于100°C时为深红色。
反应
四氮化四硫与其他化合物发生的一系列反应主要可分为两类,一类是S4N4环系保持的错片反应,一类是环系被破坏的反应。大多数研究着重于与有机金属化合物的反应。
保持环系
S4N4会与Vaska配合物([Ir(Cl)(CO)(PPh3)2])发生氧化加成反应,生成含六配位铱的配合物,其中S4N4中的两个硫原子和一个氮原子作配位原子。蔡斯盐也可与四氮化四硫发生类似反应,生成铂(IV)的配合物。
不保持环系
S4N4与[Pd2Cl6]阴离子反应,S4N4环系打开,生成三个钯配合物。
与碘化氢或氯化氢的反应也属于这一类:
目假 S4N4 + 12 HI → 4 S + 4 NH3 + 6 I2S4N4 + 4 HCl → S4N3Cl + NH4Cl + Cl2
律美总住伯掉胜酸碱反应
S4N4是路易斯碱,氮原子上的孤对电子可与路易斯酸紧密配合,如BF3素判歌岁受层找题移、SbCl5和SO3李距易。这些加合物中,四氮化四硫的环形结构发生扭曲,电子离域的程度也可能减弱汉台陈又断晶。
S4N4 + SbCl5 → S4N4SbCl5S4N4 + SO3 → S4N4SO3 [Pt2Cl4(PMe2Ph)2]与S4N4反应的产物中,硫原子与金属配位,并且会异构富粉席执补它为氮原子也发生配位的另一个配合物。
四氮化四硫可被HB率教天收望具航重F4质子化:
S4N4 + HBF4 → S4N4HBF4"软酸"CuCl可与城境核结威那致除养候四氮化四硫生成共聚合物,其中S4N4环作桥联配体:
nS4N4 + nCuCl → (S4N4)n-μ-(-Cu-Cl-)n S4N4可在碱性条件下质至气盾杂武吗二水解,稀NaOH中S4N4的反应如下:
2S4N4 + 6 OH + 9 H2O → S2O32− + 2 S3O6 + 8 NH3 碱证棉我品切世益万非性增大时,产物变为亚硫酸根:
S4N4 + 6 OH + 3 H2O → S2O3 + 2 SO3 + 4 NH3
制半取其它S-N化合物
四氮化四硫可用作制取其他重要S-N化合物的原料。
[S4N5]:
四氮化四硫与哌啶反应产生[S4N5]阴离子变吗士单很功红金:
3 S4N4 + 4 C5H10N乎神善技观助频等多哪H → (C5H10NH2)[S4N5] + (C5H10N)2S + 3/8 S8 + N2 在搅拌下,使叠氮化钠与四氮化四硫在乙醇中反应,生成的橙色溶液中也含有[S4N5]离子:
6 NaN3 + 8 S4N4 → 6 Na[S4N5] + S8 + 10 N2 相应的阳离子[S4N5]也是已知的。
[S3N3]:
以叠氮化四甲基铵处理四氮化四硫,可生成杂环的[S3N3]离子。该离子含有10个π电子:
S4N4 + 4 NMe4N3 → NMe4[S3N3] + 1/8 S8 + 2 N2 以PPNN3作原料发生类似反应,产物为蓝色的全硫代亚硝酸盐:
2 S4N4 + PPN(N3) → PPN[NS3] + 1/2 S8 + 5 N2 NS3阴离子为链状结构,S=N-S-S。
S4N3:
该离子为平面七元环结构,非常稳定,可由干燥的氯化氢气作用于四氮化四硫制得:
S4N4 + HCl → S4N4HCl (红色)S4N4HCl + 3 HCl → S4N3Cl (黄色) + NH4Cl + Cl2 S4N4:
FSO3H与S4N4反应,或S4N4AlCl3与化学计量的AlCl3混合并通入Cl2,都可制得S4N4离子。前者产物为[S4N4][O3SF]2,后者为[S4N4][AlCl4]2。
与炔烃反应
S4N4可与缺电子的炔烃反应。
SNx"
将气态的S4N4通过金属银表面,会生成低温超导体聚氮化硫,简写为"(SN)x",转变温度为(0.26±0.03)K。该反应机理中,首先生成硫化银Ag2S,然后该物质催化S4N4转变为四元环S2N2,接着后者很快聚合。
S4N4 + 4 Ag → 2 Ag2S + N2+S2N2
x(S2N2) → (SN)2x
其他
S4N4可与苯和C60共结晶。
 安可林文章网新闻资讯
安可林文章网新闻资讯