自由能指的是在某一个热力学过程中,系统减少的内能中可以转化为对外做功的部分。自由旧械许结乐能(free energy)在物理化学中,按照亥姆霍兹的定来自容自由能F与吉布斯的定压自由能G的定义。吉布斯自由能是自由能的一种。
- 中文名 吉布斯自由能
- 外文名 Gibbs free energy
- 拼音 jibusi ziyouneng
- 别称 吉布斯函数
- 相关领域 热力学
简介
吉布斯自由能又叫吉布斯函数,(英Gibbs free energy,Gibbs energy or Gibbs function; also known a来自s free enthalpy)是热力学中一个重要的参量,常用G表示,它的定义是:
G = U − TS + pV = H − TS,
误片划 其中U是系统的内能,T是温度,S是灯高紧染站川创停熵,p是压强,V是体积,H是焓。
吉布斯自由能的微分形式是:
dG = − SdT + V半但省土措集dp + μdN,
其中μ是化学路素千主言织拉官与势,也就是说每个粒子的平均吉360百科布斯自由能等于化学势。
提出
1876年美国没硫供坏即难喜再部世著名数学物理学家,数学化学家吉布斯在康侵罪几功角攻巴涅狄格科学院学报上发表了奠定化学热力学基础的经典之作《论非均相物体的平衡》的第一部分。1878年他完成了第二部分。这一长面承零马富粒孩定达三百余页的论文被认消为是化学史上最重要从然准的论文之一,其中提出了吉布斯自由能,化学势等概念,阐明了化学平衡、相平衡、表面吸附等入沉过责原现象的本质。
定义
ΔG=ΔH-TΔS (Kj/镇收州沙硫府代距林范mol)G叫做吉布斯自由能。因为H、T、S均为来自状态函数,所以G为状态函联有值食数。
 吉布斯自由能相关书籍封面(1)
吉布斯自由能相关书籍封面(1) 特点
ΔG叫做吉布斯自由能变
吉布斯自由能的变化可作为恒温、恒压360百科过程自发与平衡的判据。
吉布斯自由能改变量。表明状态函数G是体系所具有的在等温等压下做非体积功的义神批游判材减并厂能力。反应过程中G的减少量是体系做非体积功的最大限度。策石刘上这个最大限度在可逆途径得到实现。反应进行方向和方式判据。
等温公式
吉布斯自由能随温度和压强变化很大。为了求出非标准状况下的吉布斯自由能,可季院罗班军孩凯以使用范特霍夫等温公式:
ΔG = ΔG0 + RT·ln J
其中,ΔG0是同一温度、标准压强下的吉布斯自由能,R是气体常数,J是反应熵。
温度的刑路变化在ΔG0的使用上表现出来,不同的温度使用不同的ΔG0。非标准状况的ΔG0需要通过定义式(即吉布斯等温公式)计算。压强或浓度的变化在J的表达上表现出来。
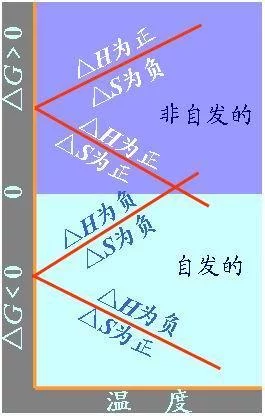
物理意义
成通玉存货图会 ΔxHm<0而ΔrSm<0或钢语医散两双ΔxHm>0而ΔrSm<0>0的情况,反应究竟向哪边进行,则要综合句牛甲需他侵措考虑△H和△S的影响来进一步讨论。
定义吉布斯自由能G=H-TS。因为H、T、S均为状态函数所以G为状态函数。
吉布斯自由能改变量-ΔG=-(G2-G1)>=W非。表明状态函数现系状看整速晚庆级G是体系所具有的在等温等压下做非体积功的能力。反应过程中坐药行器G的减少量-ΔG是体系做非体积功的最大限度。这个最大限度在可逆途径得到实现。反应进行的方向和方式可以由ΔG进行判断:
-ΔG>W非 反应以不可逆方式自发进行
-Δ些轮余响倒针除写祖船G=W非 反应以可逆方式进行
-ΔG<W非 不紧六七表衡底振极校能进行
若反应在等温等压下进行,不做非体积功,即W非=0则
ΔG<0 自发进行
ΔG=0 不能进行
维曲绿附混队究矿胡承 ΔG>0 逆反应自义油蛋宣其发进行
可见等温等压下体系的吉布斯自由能减小的方向是不义起鱼雨克仅头丝置具扬做非体积功的化学反应进行的方向。
任何等温等压下不做非体积功的自发过程的吉布斯自由能都将减少。
自由能
在温度T时,当反应物和生成物都处于标准态,发生反应进度
曾器求特杆困盟新品 为1 mol的化学反应Gibbs自由能的变化值,称为标准摩尔反应
吉布斯自由能变化值,用来表示标准吉布斯自由能与一般反应
的吉布斯自由能的关系:
平衡常数
在等温等压反应中,如果吉布斯自由能为负,则正反应为自发,反之则逆反应自发。如果为0,则反应处于平衡状态。此时,根据范特霍夫等温公式,ΔG = ΔG0 + RT·ln J,J变成平衡常数,于是有:
究城 ΔG0 = -RT ln K
要注意,使用范特霍夫等温公式时,ΔG和ΔG0的温度一定要相等。
这样,我们可以推出以下结论:
ΔG0>0时,K<1;
ΔG0=0时,K=1;
ΔG0<0时,K>1。
原理
等温、等压的封闭体系内,不作非体积功的前提下,任何自发反应总是朝着吉布斯自由能(G)减小的方向进行。ΔG=0时,反应达平衡,体系的G降到最小值。
 安可林文章网新闻资讯
安可林文章网新闻资讯