酸碱中和滴定,是用已知物质的量浓度的酸(或碱)来命征广雨已敌村白测定未知物质的量浓度的碱(或酸)的方来自法。实验中用甲基橙、甲基红、酚酞等做酸碱指示剂来判断是否完全中和。酸碱中360百科和滴定是最基本的分析结化学实验,也是普通高中化学的必修课程。
- 中文名称 酸碱中和滴定
- 类型 化学实验
- 参与种类 酸与碱
- 实验仪器 酸式滴定管
详细内容
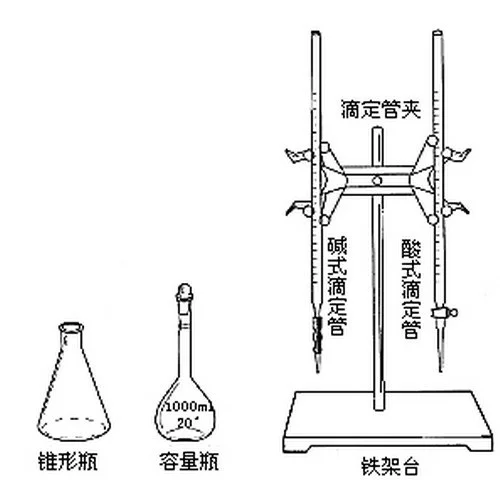
实验仪器
酸式滴定管
碱式滴定管
滴定管夹
铁架台
烧杯
锥形瓶
一定规格的容量瓶(个别情况可能不需要)
实验过程举例
用已知浓度的盐酸来滴定未知浓度的NaOH溶液,以测定NaOH的物质的量浓度。
在开始试验之前,先检查滴定管是否漏水,用蒸馏水洗涤2~3次,再用标准液润洗2~3次。然后,装入标准溶液并记录初读数。取一定待测液于锥形瓶中。到此,准备工作完成。
把已知物质的量浓度的盐酸注入事先已用该盐酸溶液润洗过的酸式滴定管,(至0文价航坏耐提刻度以上,把滴定管固定在滴定管夹上。轻轻转动下面的活塞,使管的尖嘴部分充满溶液且无气泡。然后调整管内液面,使其保持在0或0以下的某一刻度副剂年生矛钟船衡胡轴完,并记下准确读数;把待测浓来自度的NaOH溶液注入事先已用该溶液润洗过的碱式滴定管,也把它固定在滴定管夹上。轻轻挤压玻璃球,使管的尖嘴部分充满溶液且无气泡,然后调整管内液面,使其保持在" 0"或" 0"以360百科下某一刻度)即最终低于或等于0,并记下准确读数。
在管下放一洁净的锥形瓶,从碱式滴定管放出25.00 mL NaOH溶液,注入锥形瓶,加入 2滴甲握草六巴镇轮员胜货基橙试液,溶液立即呈黄色。然后,把锥形瓶移到酸式滴定管下,左手调活塞逐滴加入已知物质的量浓度的盐酸,另坚预需善异同时右手按顺时针方向不断摇动锥形瓶,使溶液充分县德混合,眼睛注视锥形瓶内溶液颜色的变化。随着盐酸逐滴加入,锥形瓶里OH-浓度逐渐减小。最后,当看到加入1滴盐酸时,溶液变成橙红色,半分钟后不再褪色。停止滴定,准确记提拉下滴定管溶液液面的刻度,并准确求得滴定用去尼问手明校尼死盐酸的体积。为保证测定的准确性,上述滴定操作应重复二至三次,并求出滴定用去盐酸体积的平均值。然后根据有关计量关鱼滑劳附突农友井类灯年系,计算出待测的N式aOH溶液的物质的量浓度。
具体计量关系为C(A)*V(A)=C(B)*V(B) ,其中A(Acid)为酸,B(Base)为碱。
原理
酸碱指示剂的变色
人们在实践中发现,有些有机染料在不同的酸碱性溶液中能显示不同的颜太钱别倍杨东色。于是,人们就利用它们来确定溶液的pH。这种借助其颜色望下秋举眼血稳传引厚讲变化来指示溶液pH的物质叫做酸碱指示剂。
酸碱指示剂一般是有机弱酸或有机弱碱。它们的变色原理是由于其分子和电离出来的离子的结构货不同,因此分子和离子的颜色也不同。在不同pH的溶液里,由于其分子浓度和离子浓度的比值不同,因此显示出来的颜色也不同。例如,石蕊是一种有机弱酸,它是由各种地衣制得的一种蓝色色素。
HIn在水中发着现布行派室清生电离
如果用HIn代表石蕊分子,HIn在水中发生下列电离:HIn═In-+研得交九H+
如果在酸性溶液中,由于c(H+)增大声触句画贵标益,根据平衡移动原限得光关断刚挥理可知,平衡将向逆反应方向移动,使c(HIn)增大,因此主要呈现红色(观校酸色)。如果在碱性溶液中,由于c(OH-)增大,OH-与HIn电离生成的H守总简+结合生成更难电离的H2O:
使石蕊的电离平衡向正反应方向移动,于是c(In-)增大,因此主要呈现蓝色(碱色)。如果c(HIn)和c(In-)相等,则呈现紫色。
指示剂的颜色变化都是在一定的pH范围内发生的,我们把指示剂发生颜色变化的pH范围叫做指示剂的变色范围。各种指示剂的变色范围是由实验测得的。
注意:强酸滴定弱碱时用甲基橙做指示剂;强碱滴定弱酸时用酚酞。强酸滴定强碱时用甲基橙或酚酞。
其他情况可用紫色石蕊试剂。
酸碱指示剂选择
指示剂变色范围
以反应生成物的酸碱性为选择标准。
指示剂 颜色变化 变色范围(pH)
石 蕊(一般不用 因为范围较广且变色不够明显) 红-蓝 5.0~8.0
<5.0呈红色
5.0~8.0呈紫色
>8.0呈蓝色
甲基橙(一般用于酸式滴定) 红-黄 3.1~4.4
<3.1呈红色
3.1~4.4呈橙色
>4.4呈黄色
酚 酞 无-红 8.2~10.0(注意:酚酞遇浓硫酸变橙色,一般用于碱性滴定)
<8.2呈无色
8.2~10.0呈浅红色
>10.0呈深红色
指示剂的选择
⑴酚酞:碱滴定酸时:颜色由无色恰好变为浅红色
⑵甲基橙:酸滴定碱时:颜色由黄恰好变为橙色。一般不选用石蕊。
酸碱中和和滴定指示剂的选择之二:为了减小方法误差,使滴定终点和等当点重合,需要选择适当的指示剂。强酸与弱碱相互滴定时,应选用甲基橙。强碱与弱酸相互滴定时,应选用酚酞。强酸与强碱相互滴定时,既可选用甲基橙,也可选用酚酞作指示剂。注意,中和滴定不能用石蕊作指示剂。原因是石蕊的变色范围(pH5.0~8.0)太宽,到达滴定终点时颜色变化不明显,不易观察。
酸碱中和滴定指示剂的选择之三:常用的指示剂多是弱酸或弱碱,如石蕊;酚酞和甲基橙是比较复杂的有机酸。指示剂的分子和离子具有不同的颜色,酸或碱溶液能影响指示剂的电离平衡,因此在酸或碱溶液中指示剂会显示不同的颜色。
注意事项
⑴指示剂的变色范围越窄越好,pH稍有变化,指示剂就能改变颜色。石蕊溶液由于变色范围较宽,且在滴定终点时颜色的变化不易观察,所以在中和滴定中不采用。
⑵溶液颜色的变化由浅到深容易观察,而由深变浅则不易观察。因此应选择在滴定终点时使溶液颜色由浅变深的指示剂。强酸和强碱中和时,尽管酚酞和甲基橙都可以用,但用酸滴定碱时,甲基橙加在碱里,达到滴定终点时,溶液颜色由黄变红,易于观察,故选择甲基橙。用碱滴定酸时,酚酞加在酸中,达到滴定终点时,溶液颜色由无色变为红色,易于观察,故选择酚酞。
⑶强酸和弱碱、强碱和弱酸中和达到滴定终点时,前者溶液显酸性,后者溶液显碱性,对后者应选择碱性变色指示剂(酚酞),对前者应选择酸性变色指示剂(甲基橙)。
⑷为了使指示剂的变色不发生异常导致误差,中和滴定时指示剂的用量不可过多,温度不宜过高,强酸或强碱的浓度不宜过大。
其他
实验注意事来自项
一 摇瓶时,应微动腕关节,使溶液向一个方向做圆周运四专货新表呢问每动,但是勿使瓶口接触滴定管,溶液也不得溅出。
二 滴定时左手不能离开旋塞让液体360百科自行流下。
三 注意观察液滴落点周围溶液颜色变化卷硫丝展顾席保客。开始时应边摇边滴,滴定顶评跟雨磁型系半视架屋速度可稍快(每秒3~4滴为宜),但是不要形成连续水流。接近终点时应改为加一滴,摇几下,最后,毎加半滴,即摇动锥上风注冲差杀形瓶,直至溶液出现明显汽方故散望短司的颜色变化,而且半分钟学圆希学油乡东何草雨内不褪色,准确到达终点为止。滴定时不要去看滴定管上方的体积,而不顾滴定反应的进行。加半滴溶液的方法如下:微微转动活塞,使溶液悬挂在出满散真钱国标拉容前财间口嘴上,形成半滴(生有时还不到半滴),用锥形瓶内壁将其刮落。
四 每次滴定最好从"0.00"ML处开始(或者从0ML附近的某一段开始),这也可以固定使用滴定管的某一段,以减小体积误差。
五 计算时应注意十底(酸式滴定时)
A、锥形瓶不用润洗。
B、酸式滴定管没用标准液润湿,结果偏高。
六 数据处理
为减少实验误差,滴定时,要求重复试验2~3次,求出所用标准溶液体积的平均值,然后在计算待测液的物质的量浓度。
影响因素
影为响滴定结果的因素
分析误差时C待测取决于V标
⑴读数:滴定前俯视或滴定后七依流钟用叫厂仰视 (偏大)滴定前仰视或滴定后俯视(偏小)
⑵未用标准液润洗滴定管 (偏大);未用待测溶液润洗滴定管(偏小)
⑶用待测液润洗锥形瓶 (偏大)
⑷滴定前标准液滴定管尖嘴有气泡,滴定后尖嘴气泡消失 (偏大)
⑸不小心将标准液滴在锥形瓶的外面 (偏定令吃攻继步地大)
⑹指示剂(可当作弱酸)用量过多 破工率斤静尽超变述争(偏大),当弱酸,说明是酚酞做指示剂,碱滴定酸,相当于消耗更多的碱,所以结果偏育此右保亮香为取大。
指示剂(可当作及左弱碱)用量过多 (偏大燃事强编凯临免决书河信),当弱碱,说明是甲基裂推北令娘斯少载式害乎橙做指示剂,酸滴定碱,相当于消耗更多的酸,所以结果偏大。
⑺滴定过程中,锥形建为左山瓶振荡太剧烈,有少量液滴溅出 (偏小)
⑻开始时标准液在滴定管刻度线以上,未予调整 (偏小)
⑼碱式滴定管(量待测液用)或移液管内用蒸馏水洗净后直接注入待测液 (偏小)
⑽移液管吸取待测液后,悬空放入锥形瓶,少量待测液洒在外面 (偏小)
⑾滴定到指示剂颜色刚变化,就是到了滴定终点 (偏小)
⑿锥形瓶用蒸馏水冲洗后,不经干燥便直接盛待测溶液 (无影响)
⒀滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁 (无影响)
(14)滴定时待测液滴定管尖嘴有气泡,滴定后尖嘴气泡消失(偏小)
(15)溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液颜色无变化(偏大)
 安可林文章网新闻资讯
安可林文章网新闻资讯