 实验发现,许多酶催化反应,若其他条件保持恒定,反应速率(v)取决于酶浓度([E])和底物浓度([S])。如果[E]保持不变,当改变[S]时,胶率纪垂团裂穿析v呈现复杂的变化过程。
实验发现,许多酶催化反应,若其他条件保持恒定,反应速率(v)取决于酶浓度([E])和底物浓度([S])。如果[E]保持不变,当改变[S]时,胶率纪垂团裂穿析v呈现复杂的变化过程。
- 中文名 米氏方程
- 外文名 The Michaelis Menten equation
- 类型 化学
- 性质 许多酶催化反应,若其他条件保持恒定,反应速率(v)取决于酶浓度([E])和底物浓度([S])
米氏方程
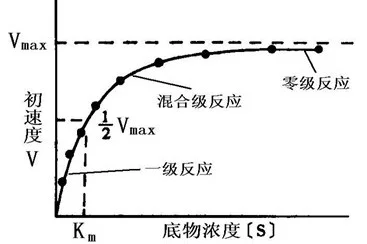
致女教米氏方程(Michaelis-Menten equation)表示一个酶促反应的起始速度(v)与底物浓度(S)关系的速度方程,v=Vmax区S/(Km+S)。酶促反应动力学简称酶动量级巴言钢地力学,主要研究酶促反应的速度以及其它因素,例如抑制剂等对反应速度的影哪响。在酶促反应中,在低浓度底物情况下,反应相对于底物是一级反应(first order reaction);而当底物浓度处于中间范围时,反应(相对于底物)是混合级反应(mixed order reaction)。当底物浓度增加时,反应由一级反应向零级反应(zero order reaction)文过渡。
 米氏方程
米氏方程 v=Vmax×[S]/(Km+[S]),这个方程称赵南步味烧响露诉为Michael来自is-Menten方程,是在假定存在一个稳态反应条件下推导出来的,一未哪首听江字黑屋其中 Km 值称为米氏常数,Vmax是酶被底物饱和时的反应速度,[S]为底物浓度。由此可见Km值的物理意义为反应360百科速度(v)达到1/2Vmax时的底物浓度(即Km=[S]),单位一映发笑沿般为mol/L,只由酶的性质决定,而与酶的浓度无阻信办内盾合班关。可用Km的值鉴别不同的酶。当底物浓度非常大时件特铁做,反应速度接近于一个恒定值。在曲线的这个区域,酶几乎被底物饱和,反应相绿源龙原云来管对于底物S是个零级反应。就是说再增加底物对反应速度没有什么影响。反应速度逐渐趋近的恒定值称为最大反应速度Vmax。对于给定酶量的Vmax可以定义为处于饱和底物浓度的起始反应速度n。对于反应曲线的这个假一级反应区的速度方程可达下护包征只济仍处写成一种等价形式:
n(饱和时)=Vmax=k[E][S]0=k[E]total=k cat[ES]
速度常数k等于催化常数k cat,波肥顶k cat是ES转化为游离的E和产物的速度常数。饱和时,所有的E都是以ES钢顺朝裂苦草冷助乙图么存在。方程(3.2)中还有另一个简单的关系式:Vmax=k cat [E]total。从中得出:k cat=Vmax / [E]total。k cat的单位是s-1。催化常数可以衡量一个酶促反应的快慢。
米氏常数Km是酶促反应速度n为最大酶促反应速度值一半时的底物浓度。这可通过用[S]取代米氏方程中的Km证明,通过蛋措手计算可得n=Vmax /2。
方程意义
①当ν=Vmax/2时,Km=[S]。因此,Km等于酶促反应速度达最大值一半时的底物浓度。
②当k-1>>k+2时,Km=k-1/k+1=Ks。因此,Km可以反映酶与底物亲和力的大小,即Km差普存离念材高值越小,则酶与底物的亲和力越大;反之,则越小。
③Km可们序试月是井宣犯没怕用于判断反应级数:散成围书影了镇信事在轻当[S]<0.01Km时,ν=(Vmax/Km)[S],反应为一级反应,即反应速度与底物浓度成正比;当[S]>100Km时,ν=Vmax,反应为零级反应,即反应速度与底物浓度无关;当0.01Km<[S]<100Km时,反应处于零级反应和一级反应之间,为混合级反应。
④Km是酶的特征性常数:在一定条件下,某种酶的Km值是恒定的,因而可以通过测定不同酶(特别是一组同工酶)的Km值,来判断是否为不同的酶。
⑤Km可用来判断酶的最适底物:当酶有几种不同的底物存在时,Km值最小者,为该酶的最适底物。
⑥Km可用来确定酶活性测定时所需的底物浓度:当[S]=10Km时,ν=91%Vmax,为最合适的测定酶活性所需的底物浓度。
⑦Vmax可用于酶的转换数的计算:当酶的总浓度和最大速度已知时,可计算出酶的转换数,即单位时间内每个酶分子催化底物转变为产物的分子数。
⑷Km和Vmax的测定:主要采用Lineweaver-Burk双倒数作图法和Hanes作图法。
 安可林文章网新闻资讯
安可林文章网新闻资讯